Second Sight erhält Genehmigung des Bundesinstituts für Arzneimittel und Medizinprodukte für die Einleitung einer Studie über die Implantation und Bewertung von Argus II bei Retinitis-pigmentosa-Patienten mit Restsehfähigkeit
Sylmar, Kalifornien, USA, 17. Oktober 2017 – Second Sight Medical Products, Inc. (NASDAQ:EYES) („Second Sight“ oder „das Unternehmen“), ein Entwickler, Hersteller und Vermarkter von implantierbaren Sehprothesen zur Wiederherstellung eines nützlichen Sehvermögens bei erblindeten Patienten, gab heute bekannt, dass das Unternehmen die Genehmigung des zuständigen deutschen Bundesinstituts für Arzneimittel und Medizinprodukte („BfArM“) und eine positive Stellungnahme des zuständigen Ethikausschusses für die Einleitung einer Studie mit 10 Patienten zur Implantation und Bewertung des Argus® II Netzhautprothesensystems („Argus II“) bei Patienten mit weniger schwer ausgeprägter Retinitis pigmentosa („RP“) oder mit einem gewissen Grad an „Tunnelblick“ in Deutschland erhalten hat. Tunnelblick ist eine Sehstörung, bei der das Gesichtsfeld schwer eingeschränkt ist.
Die klinische Studie wird mit führenden Studienleitern an den folgenden drei Standorten in Deutschland durchgeführt: Universitätsklinikum Aachen unter Professor Walter, Städtisches Klinikum Karlsruhe unter Professor Augustin und Universitätsklinikum Schleswig-Holstein, Universitätsklinikum Lübeck, unter Professor Grisanti. Der primäre Endpunkt der Studie besteht in der Messung der durch Argus II bei RP-Patienten mit Tunnelblick erzielten Vergrößerung des Gesichtsfeldes. Ein sekundärer Endpunkt besteht in der Bewertung, wie weit es den mit Argus II behandelten Probanden gelingt, das System in ihr tägliches Leben zu integrieren.
„Dies ist eine wichtige Studie und Teil unserer Strategie zur Bewertung von Argus II bei Patienten mit weniger schwerem Sehverlust. Wir freuen uns sehr über die Gelegenheit, potenziell das funktionale Sehvermögen weiterer sehbehinderter Menschen mit RP zu verbessern. Mit der Aufnahme von Probanden soll noch vor Jahresende begonnen werden. Sollte die Studie erfolgreich verlaufen, dann könnte die vorgesehene Patientenpopulation den potenziellen Markt für Argus II verdoppeln oder verdreifachen“, erklärt Will McGuire, President und Chief Executive Officer von Second Sight.
„Diese Studie könnte potenziell die Behandlung von RP verändern und im Falle des Erfolgs die Patientenpopulation, die von dieser Behandlung profitieren und für die Argus II eine Lösung sein könnte, wesentlich erweitern“, kommentiert Professor Walter, Universitätsklinikum Aachen.
Teilnehmen an der Studie für Sehbehinderte
Sehbehinderte Patienten, die an einer Teilnahme an der klinischen Studie über Argus interessiert sind, wenden sich bitte an Second Sight unter der in Deutschland gebührenfreien Rufnummer 0800 184 4321. Sie werden dann für weitere Informationen und eine Prüfung, ob Sie für die Teilnahme an dieser Studie in Frage kommen, an den geeigneten Studienstandort überwiesen.
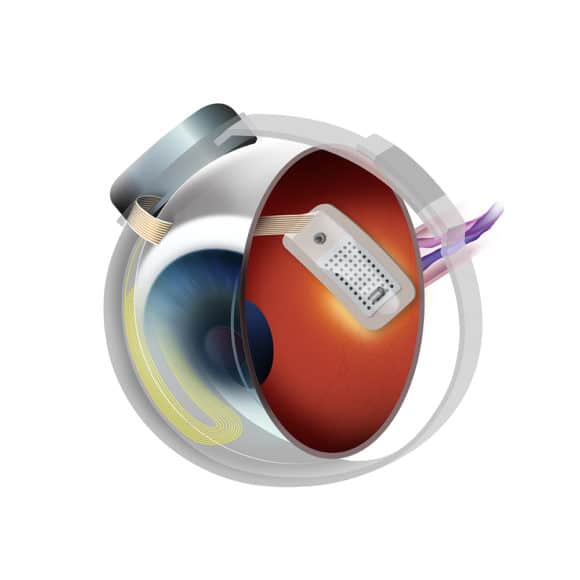
Über das Netzhautprothesensystem Argus II
Das Argus-II-System von Second Sight erzeugt eine elektrische Stimulation, bei der die geschädigten Netzhautzellen umgangen und die verbliebenen funktionstüchtigen Zellen stimuliert werden können, um auf diese Weise bei Personen mit schwerer bis hochgradiger Retinitis pigmentosa eine visuelle Wahrnehmung hervorzurufen. Das Argus-II-System wandelt die von einer winzigen Videokamera in der Brille des Patienten aufgenommenen Bilder in eine Reihe kleiner elektrischer Impulse um, die drahtlos an ein Elektrodengitter gesendet werden, das auf der Oberfläche der Netzhaut implantiert ist. Diese Impulse stimulieren die verbliebenen Netzhautzellen, so dass im Gehirn Lichtmuster wahrgenommen werden sollen. Der Patient muss lernen, diese visuellen Muster zu interpretieren, und kann dadurch eine gewisses Maß an funktioneller Sehkraft zurückgewinnen. Argus II ist die erste künstliche Netzhaut, die in vielen Ländern zugelassen wurde. Sie wird in registrierten Behandlungszentren in Kanada, Frankreich, Deutschland, Italien, Russland, Saudi-Arabien, Südkorea, Spanien, Taiwan, der Türkei, Großbritannien und den Vereinigten Staaten von Amerika angeboten. Weitere Informationen über die Vorteile und Risiken des Systems erhalten Sie in dem referierten Fachartikel unter: http://www.sciencedirect.com/science/article/pii/S0161642016305796
Über Second Sight
Second Sight hat sich das Ziel gesetzt, innovative implantierbare Sehprothesen zu entwickeln, herzustellen und zu vermarkten, um erblindeten Patienten eine größere Unabhängigkeit zu verleihen. Second Sight hat das Netzhautprothesensystem Argus® II entwickelt, das jetzt auch vom Unternehmen hergestellt und vermarktet wird. Die Aufnahme von Patienten in eine Machbarkeitsstudie, mit der die Sicherheit und Wirksamkeit von Argus II bei Patienten mit trockener altersbedingter Makuladegeneration geprüft werden soll, ist abgeschlossen. Second Sight entwickelt auch die Sehrindenprothese Orion™ zur Wiederherstellung einer gewissen Sehfähigkeit bei Personen, die aus nicht vermeidbaren oder behandelbaren Ursachen erblindet sind. Der Hauptsitz von Second Sight in den USA befindet sich in Sylmar, Kalifornien, der europäische Hauptsitz in Lausanne, Schweiz. Weitere Informationen erhalten Sie auf der Website: www.secondsight.com